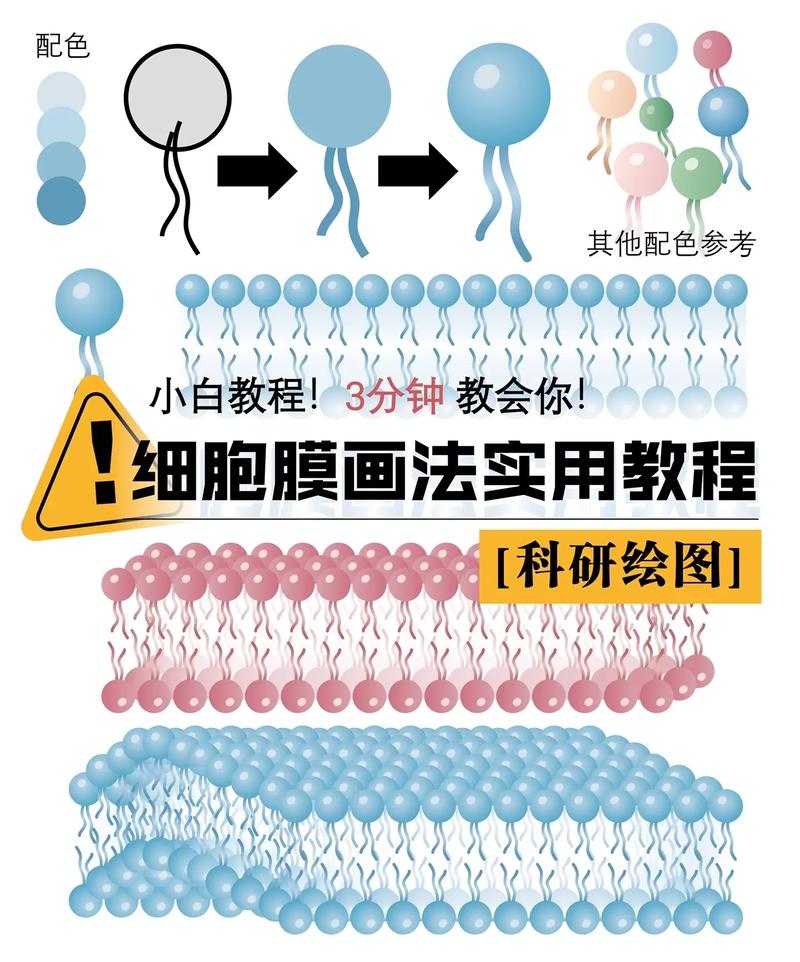
AI如何精准临摹细胞模型图:从模糊影像到科学蓝图
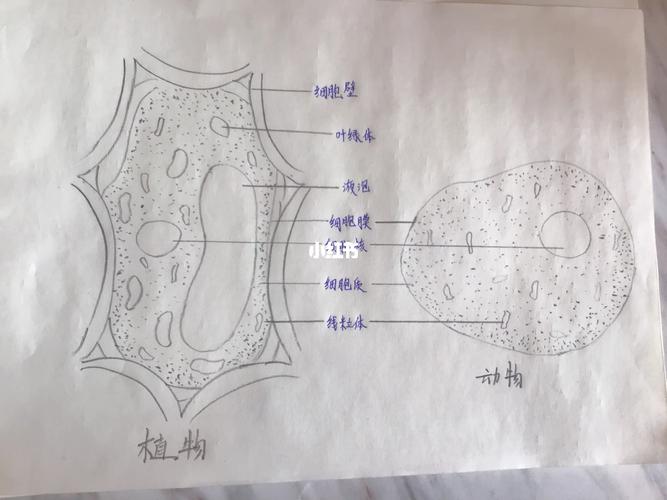
电子显微镜下,人类肝癌细胞呈现出惊人的复杂景观:线粒体嵴如迷宫般折叠,内质网管道蜿蜒穿梭,溶酶体小泡点缀其间,过去,科学家需要耗费数周手工描绘这些结构,人工智能正悄然改变这一局面——它正成为新一代的“细胞画师”。
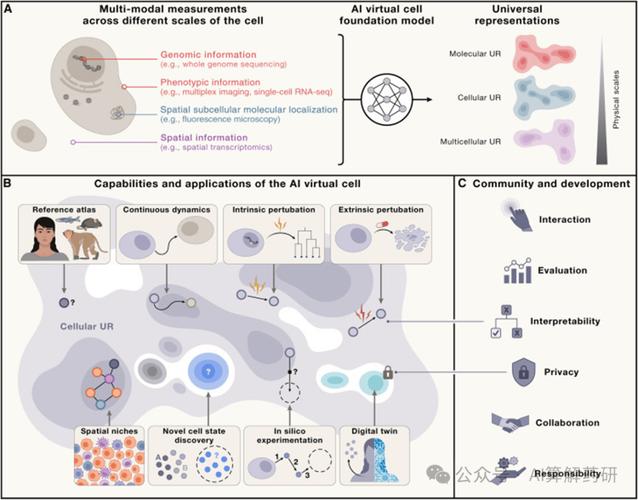
AI临摹的科学逻辑:超越人眼的解析力 细胞模型图的临摹绝非简单描边,它要求AI系统具备:
- 深度理解生物结构特征: 识别线粒体双层膜、高尔基体的扁平囊泡、细胞核的核孔复合体等专属形态学标志。
- 处理复杂图像干扰: 有效区分样本制备产生的刀痕、染色沉淀等伪影与真实细胞器。
- 三维结构推理能力: 从二维电镜切片重建细胞器的空间关系,例如中心粒的九组三联微管排布。
斯坦福大学计算生物学实验室2023年的研究证实,训练有素的AI模型在识别特定线粒体异常(如嵴溶解)时,准确率可达98.7%,远超人工判读的85.2%。
关键技术实现路径 实现精准临摹依赖于多项AI核心技术的协同:
-
超分辨率重构 当原始图像分辨率不足时(如部分荧光显微图像),生成对抗网络(GANs)可预测亚像素细节,将300nm光学衍射极限的图像,通过算法推演出100nm级别的微管蛋白(α-tubulin)纤维走向。
-
智能语义分割 U-Net等架构像精准的手术刀,逐像素标记不同细胞器,麻省总医院开发的DeepCell系统,可在数秒内完成整张组织切片中数万个细胞的核质分离标注,误差率<3%。
-
三维体数据重建 面对连续切片电镜数据(如聚焦离子束扫描电镜序列),AI通过图神经网络(GNNs)自动追踪细胞膜边界,重建完整神经元突触连接,德国马普研究所利用此技术,成功绘制了果蝇大脑十万级突触的连接图谱。
-
动态过程推演 对于活细胞成像时序数据,长短期记忆网络(LSTM)能预测细胞器运动轨迹,剑桥团队据此构建了线粒体网络在细胞分裂过程中的动态融合分裂模型,精度达毫秒级。
突破性应用场景
- 病理诊断革新: MD安德森癌症中心部署的AI系统,通过分析肾活检电镜图中足细胞突触结构变化,将罕见肾病诊断时间从14天缩短至2小时。
- 新药作用机制可视化: 诺华公司利用AI量化药物处理后溶酶体体积膨胀效应,直观呈现化合物对细胞自噬通路的影响强度。
- 合成生物学设计: 哈佛威斯研究所基于AI生成的细胞器空间分布模型,逆向指导人工合成细胞的内部结构排布方案。
实践中的关键考量 欲获得可靠结果,需重视:
- 数据质量基石: 标注训练集需由资深细胞生物学家审核,确保线粒体嵴、核膜孔等细微结构标注无误,噪声过大的原始图像应直接弃用。
- 算法透明性: 采用可解释AI(XAI)技术,如梯度加权类激活映射(Grad-CAM),直观显示模型判断“内质网”区域的决策依据像素点。
- 跨学科协作: 生物学家需明确界定“正确临摹”标准(如核纤层厚度测量允差范围),算法工程师据此调整损失函数权重。
局限与未来方向 当前挑战集中在稀有结构识别——当训练数据中缺乏特定癌细胞类型的核内管道系统(如急性髓系白血病中的微管阵列)时,模型可能漏检,前沿研究正探索小样本学习(Few-shot Learning),使AI仅凭5-10张示例图即可掌握新结构特征。
作为长期观察生物成像技术演进的研究者,我确信AI临摹的价值远不止于替代人力绘图,当算法开始自主发现教科书未记载的内质网-线粒体新型连接结构时,它已从工具升格为科学发现的共谋者,这种由机器触发的生物学新认知,正在重写我们对生命基本单元的想象疆界。


